この記事では医薬品の説明書となる添付文書とは何かということを解説しつつ、添付文書の読み解き方についても説明していきます。
先日、風邪で処方薬を調剤薬局でもらったときのこと。
薬の説明用紙(専門的には薬剤情報提供書、簡単に薬情って言ったりします)を見たのですが、注意書きとして副作用がたくさん書いてありました。
私は薬剤師だから気になりませんが、一般の方にとっては副作用がたくさん書いてあると過度に不安感を持ってしまう人もいそうです。
さらに不安に思う人はインターネット検索したりするのではないでしょうか?
そのなかの情報は玉石混交だったりしますが、その情報の中には処方薬の公的文書である添付文書というものがあります。


添付文書とは
添付文書とは医師などの医療従事者を含む、製品の使用者を対象に作成され、患者さんの安全のために医薬品や医療機器を正しく適切に使用するための重要な公的文書。
インターネットが普及する以前、添付文書が一般の方々の目に触れる機会はほとんどなかったと思いますが、インターネットやスマートフォンが普及した現在では、誰でも簡単にこの添付文書の情報にアクセスすることができます。
添付文書は公的文書なので「この文書を読めば正しい情報が得られるし、お医者さんや薬剤師さんの説明なんか聞かなくても大丈夫!」なんて思う人もいるかもしれませんね。
では本当に添付文書に書いてあることを見ておけば、その薬について全て理解することができるのでしょうか?
いえ、決してそんなことはありません。
添付文書を読み解くには独特のテクニックが必要ですし、専門的知識が必要になります。
さらに実践的なことを考えると添付文書以外の情報についても理解していなければいけません。
一般の方が薬の情報を得るために添付文書を利用するにはリスクがありますが、インターネットで検索すれば簡単にアクセスできてしまうことを考えると、一般の方も添付文書がどういったものか知っておいたほうがいいかもしれません。
ということで、このページでは添付文書に書かれている内容や添付文書を読むときの注意点について解説していきたいと思います。
まずは添付文書に書かれている内容について項目ごとに説明していきます。
注)この記事は2019年3月以前の記載要領に沿った添付文書情報を対象としています。
名称

添付文書には販売名が記載されていますが、それ以外に一般名称あるいは日本薬局方で定められた名称が併記されています。
例えるならば、サランラップ(販売名)と食品用ラップフィルム(一般名称)の関係。これが併記されています。
トランサミンの添付文書の場合、販売名のトランサミンと一般名称のトラネキサム酸が併記されています。ただトラネキサム酸は日本薬局法の収載品なので、表記もそれに沿ったものになっています。
トラネキサム酸は肝斑に効くことが知られており、「トランシーノⅡ」などの化粧品にも含まれているので、美容に興味のある方などはもしかしたら、トラネキサム酸のほうが馴染みがあるのではないでしょうか。
ジェネリック医薬品が広く普及している現在では、化粧品だけではなく処方薬も先発品のトランサミンよりもジェネリック医薬品の名称に用いられるトラネキサム酸の方が身近かもしれませんね。
補足ですが、現在発売されているジェネリック医薬品の多くは、一般名称の後ろに「」内でメーカーの屋号が表記された販売名(ex.トラネキサム酸「日医工」など)となっていることが多いです。
禁忌

「禁忌!」ということですから、これはもうこの薬を使っちゃダメって患者さんが具体的に表記されています。
禁忌に該当する患者さんにその薬が投与されることは原則ありませんし、医療現場も細心の注意を払っています。
トランサミンが禁忌となる患者さんは止血剤のトロンビンが投与されている場合になりますが、通常、かなり出血している状況でないとトロンビンは投与されません。
ですのでほとんどの場合、トランサミンが禁忌になることはまずありません。
組成・性状
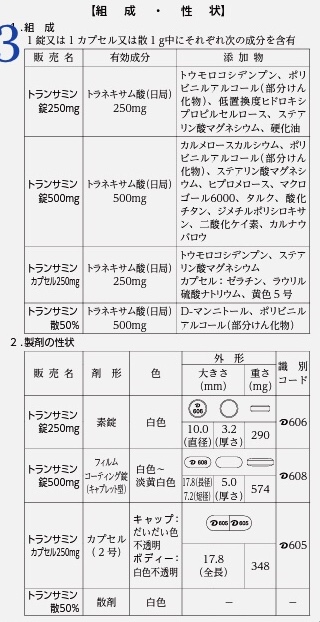
組成
組成には錠剤なら1錠中に含まれる有効成分の量と添加物の成分が記載されています。
添加剤は原則すべて記載しなければいけませんが、pH調整剤・等張化剤・香料は簡略化して用途名記載にしてもいいとされています。また水に関しては記載を省略してもいいとされています。
ジェネリック医薬品は必ずしも先発品と同じ添加物ではありません。乳糖不耐症などがある患者さんなどもいるので、添加剤の情報には注意が必要です。
性状
製剤の性状には識別上に必要な色、味、におい、形状、識別コードなどが記載されます。
薬剤師はパッケージされていない状態の医薬品でも、こういった性状を見れば概ね商品を特定することができます。
トランサミンの場合、錠剤、カプセル、散剤が商品化されていますが、それ以外にも注射剤としても販売されています。
効能・効果

ここには承認を受けた効能または効果が記載されていて、これ以外の目的で投与する場合は保険適応外となり自費となります。
トランサミンに関しては出血や感冒などの炎症、蕁麻疹などのアレルギーに対しする投与には保険適応されます。
トランサミンは肝斑などシミにも有効と言われていますが、保険適応はありませんので自費診療になります。
用法・用量

承認を受けた投与方法(用法)と投与量(用量)が記載されます。なお、医薬品によっては効能または効果に応じて用法及び用量が異なるものがあります。
トランサミンはどの効能でも同じ投与量で1日750mg〜2,000mgを3〜4回に分割して投与します。
ちなみに適応外の肝斑に対するトランサミンの投与量はどうかというと、基本的には他の投与量と同じですね。
肝斑に対してトランサミンの効果が分かるまでに750mg投与で6週間、1,500mg投与で 4 週間かかると言われています。また内服を中止すると4〜8週間で色が濃くなるとも言われているので、長期的に飲む薬になります。
Hyun Jung Kim et al. Acta Derm Venereol.2017.
慎重投与

いろいろな理由で他の患者さんよりも副作用による危険性の高い患者さんが、慎重投与として記載されます。
慎重投与に該当する患者に対しては、投与の可否や用法及び用量について慎重な判断が必要になります。また検査の検討や注意深い観察が必要ともなります。
トランサミンの場合、止血作用。この作用によるリスクが高くなるような患者さんには慎重に投与しないといけません。特に血栓ができやすい状態の人や腎臓が悪い人は要注意です。
ただ血栓のリスクは高くないので過度に怖がる必要はありません。
ただピルを服用しているような女性の場合、少し注意が必要になります。ピルによる血栓のリスクは有名ですが、トランサミンの併用でリスクが高くなる可能性が否定できません。
ピルとトランサミンの併用可否の判断はケースバイケースになりますので、ピルを飲んでいる場合はしっかり医師にそのことを伝えましょう。
ここで注目していただきたいのは、ピルについて何も添付文書に書いていないことです。添付文書に書いていないから問題ないというわけではなく、書いてある情報からリスクを推測することも薬剤師の役割になります。
相互作用


相互作用とは他の医薬品を併用することで、その医薬品や併用薬の効果が強くなりすぎたり、逆に弱くなってしまうことです。さらに副作用の発現にも影響が出たりします。
これには薬だけではなく飲食物等との相互作用も含まれ記載されます。
そしてこの影響の大きさによって併用禁忌や併用注意に分類されていきます。
併用禁忌とは言葉のとおり、併用してはダメな薬。絶対に一緒には飲んでいけません。
一方で併用注意は禁忌とまでは言わないけど、副作用や効果の変化に注意しながら使用すべき薬が列挙されています。
相互作用には薬力学的と薬物動態学的の2種類に分類されます。
薬力学的相互作用は一緒に使われる薬同士の効果(あるいは副作用)そのものが影響しあって、過剰に効果が現れたり、逆に弱くなってしまうことです。
たとえばビタミンKが豊富に含まれている納豆と抗凝固薬のワルファリン。
ワルファリンは血液を凝固させる過程において、ビタミンKの働きを阻害することで抗血栓効果を発揮するので、納豆からビタミンKが供給されると拮抗的に効力が減弱してしまいます。
薬物動態学的相互作用は、薬が吸収・分布・代謝・排泄といった過程で他の薬剤と相互的に影響して起こる反応のことを言います。
一つの例としては喫煙と抗精神病薬のオランザピンがあります。
毎日喫煙することでタバコに含まれる物質によって、肝臓などにある薬物を代謝する酵素(CYP1A2)の合成が徐々に誘導されます。
オランザピンは、このCYP1A2によって代謝され体内から除去されますが、CYP1A2が増えることで代謝が促進され効果が減弱してしまいます。
ここに書いてきた相互作用はごく一部ですので、薬剤ごとに相互作用が起きないか確認しなくてはいけません。
トランサミンは基本的に薬理学的相互作用による血栓リスクのために、併用を避けたり注意しなければならない薬剤が添付文書には表記されています。
ただし添付文書の改定はリアルタイムで更新はされないので、添付文書に書かれていない薬剤などで相互作用が起きるかもしれないという想像力は常に持っておくべきだと思っています。
副作用

添付文書にはまず副作用の発生状況の概要が記載されています。
副作用等の発生状況には調査症例数、調査の情報源、記載時期(承認時、安全性定期報告時、再審査終了時、再評価結果等)が明記されています。また調査結果に基づいた調査症例数が発生頻度として記載されています。
そして特に注意を要する副作用として「重大な副作用」、そしてそれ以外として「その他の副作用」が記載されます。
臨床的に副作用を正しく判断するにあたり、添付文書を活用する場合には様々な注意点があります。とにかく「添付文書に書いてあるから副作用だ」ということに陥らないことを常に心がけなくてはいけません。
ここからは副作用についての考え方を少し掘り下げていきたいと思います。
日本と海外の違い
前述のように承認時や安全性定期報告時、再審査終了時などにおける副作用の頻度が添付文書には記載されています。
米国や欧州の場合、薬の副作用頻度だけではなく対照群(プラセボなど)の副作用の頻度も添付文書には記載されているので、その薬を使用することでどれくらい副作用のリスクが上がるかといったこと分かります。
しかし日本の場合、薬を使用したときの副作用と疑われる事象の頻度のみが記載されているので、リスクを定量的に評価することができません。
また、副作用のとらえ方も欧米と日本では違います。
薬が投与されたときに生じた好ましくない医療上の事象を有害事象といいますが、これは投与された医薬品との因果関係は関係ありません。
欧米の場合、生じた有害事象と薬の因果関係に「合理的な可能性がある」ものを副作用としています。
一方、日本では生じた有害事象に薬が「関連あり」・「関連があるかもしれない」・「おそらく関連なし」・「関連なし」とあるうちの「関連なし」以外を「因果関係を否定できない有害事象」とし、これを副作用としています。
すなわち日本の添付文書にはこの因果関係が高くないレベルの有害事象も副作用としてとして登録されています。
たとえば鉄欠乏性貧血などで使われる鉄剤のフェロミア。この薬の副作用には「めまい」や「倦怠感」などがありますが、この症状は貧血でも発生する症状です。
このような症状が発生した場合、フェロミアによる副作用か貧血による症状か判断できないですが、フェロミアの副作用として添付文書に登録されます。
裁判では「推定無罪」となりますが、薬の場合は逆に「推定有罪」となります。
トランサミンの副作用に「悪心」や「食欲不振」などがありますが、たとえば出血に対してトランサミンが投与された場合、自分の流血を見てしまった不快感や血液そのものが減少した影響、はたまた病院での止血処置の影響はまったくないと言えるでしょうか。
それでも推定有罪となり悪心や食欲不振は、トランサミンの副作用として登録されます。
薬剤師は添付文書に登録されている副作用はデータとして参考にしますが、それだけを鵜呑みにするわけではなく、疾患の病態・症状から総合して副作用を評価しています。
治験で評価していないと記載されない
これは重要なことですが、「添付文書に記載されていない副作用は発生しない」ということは言えません。
たとえば「倦怠感」。
これは患者さんの訴えに基づく副作用ですが、「体がだるくなったと感じた場合、それも副作用になりますから教えてくださいね」と事前に説明したかどうかによって、その発生頻度は変わってきます。
ただ「何か変わったことがあれば教えてくださいね」と説明しただけだと、この倦怠感という副作用は発見されないかもしれません。
一方、客観的指標である血液検査などの場合、治験時に測定されなければその変化はもちろん分からないので、副作用には記載されません。
というように添付文書に副作用が記載されていないからと言って絶対安心とは言い切れませんので注意してください。
Rule of Three
仮に治験で評価した副作用が発生しなければ、もちろん添付文書にその副作用は記載されません。しかし、だからといってその副作用が絶対に発生しないかと言えば、そうとは言い切れません。
みなさんは「Rule of Three」という法則を聞いたことがあるでしょうか。
これは薬剤の市販後に生じ得る重篤な副作用などの稀な事象の発生に成り立つ法則です。
「Rule of Three」=n人調べて1度も副作用が観測されなくても、他のn人中の3人に副作用が観測される可能性がある。
たとえば、100人調べて1度も副作用が観測されなくても、別の100人中3人に副作用が発生する可能性があり、10,000人調べて1度も観測されなくても別の10,000人中3人に発生する可能性がなお残っているということです。
添付文書の副作用を評価するとき、総症例数が何例であるか確認することは重要となります。
特に新薬、さらに言えば迅速審査で承認されたような新薬(新型インフルエンザ治療薬など)の添付文書の総症例数は重要となり、症例数が少なければ未知の副作用が発生する確率が高くなります。
新薬ではありませんが、トランサミンの添付文書の総症例数は2,954例ですので、未知の副作用が約0.1%発生する可能性は否定できません。
とはいってもトランサミンは40年近く使われている医薬品であり、2,954例よりずっと多くの患者さんに投与されているので、未知の副作用が発生する可能性はかなり少なくなっています。
症例数が少ない新薬が投与されている患者に対しては、慎重に副作用が発生しないかモニタリングすることが医師や薬剤師には求められています。
ノセボ効果
プラセボ効果は有名だと思いますが、ノセボ効果はご存じでしょうか。
プラセボ効果とは薬理活性成分を含まない偽薬を投与しても、心理的効果や自然治癒などの影響により症状が改善することをいいます。
ノセボ効果とはプラセボ効果の逆で、副作用を懸念する心理によって偽薬でも望まない副作用があらわれてしまうことを言います。
もちろん添付文書に記載されている副作用にもノセボ効果が影響している可能性も否定できません。
薬剤師が患者さんに副作用を説明する場合、ノセボ効果による副作用を引き起こす可能性があることを十分に考慮しなければなりません。
説明すべきことはしっかり説明しなければなりませんが、プラセボ効果を最大限に発揮させつつノセボ効果を最小限に抑えることができるコミュニケーションスキルは薬剤師に求められる重要な要素だと思います。
臨床推論
臨床推論とは「当該患者の疾病を明らかにし、解決しようとする際の思考過程や内容」と定義されていて、医師が診断するまでの思考プロセスが代表的なものとなります。
ただこの臨床推論は患者さんからさまざまな情報を集めて、診断するだけではなく、緊急性・治療薬選択・治療効果・副作用などを判断していく過程でも重要なプロセスになります。
このプロセスは最初に得た患者さんの情報から仮説を立てて、情報を吟味、追加収集して、仮説検証することを繰り返します。
これには医療従事者の知識・経験・価値観など内的なリソースと、患者さんやその家族・目的・利用可能な機器・人員など外的なリソースの両方に影響を受けます。
薬剤師が副作用を評価するためにはこの臨床推論が重要となります。
病院薬剤師と薬局薬剤師ではこの外的リソースが異なることもありますが(たとえば検査結果が分からないなど)、患者さんの背景、症状や訴えなどを確認し、薬剤師の内的リソースを駆使して副作用の有無を評価します。
薬剤師が陥る典型として、目の前の症状や検査結果と添付文書に書かれている内容が一致した場合、早計に副作用と判断してしまうことがあります。
実際には副作用ではなく、病態の悪化であったり、まったく別の要因が存在していたりすることがしばしばあります。
薬の知識だけではなく、前述したような副作用への理解、疾患・病態・検査値などの知識や経験を備えたうえで、臨床推論から丁寧に患者さんの状態を評価することで、副作用かどうかの判断もできるようになると思います。
高齢者への投与

薬は飲むと小腸などの消化管から吸収され、全身に分布して薬の効果が発揮されます。その後、薬は肝臓などで代謝されて無毒化されたり、腎臓などを介して体の外に排泄されます。
加齢とともにこのすべての過程に変化が起きますが、特に肝臓による代謝機能や腎臓による排泄機能が低下して薬が蓄積しやすくなる傾向にあります。
薬が蓄積することで副作用が発生しやすくなるため、薬の投与する量を減らすなどの対応が必要となります。
たとえば主に腎臓を介して排泄されるトランサミンの場合、腎機能が低下することで副作用の痙攣があらわれるリスクがあるので、高齢者に投与する場合は腎機能を確認する必要があります。
正常の腎機能であれば一日750~2,000mgを連日投与しますが、腎機能によっては一回250~500mgを週に3回しか投与できないこともあります。
妊婦、産婦、授乳婦等への投与
妊産婦さんや授乳婦さんに薬を投与する場合、胎児や母乳を介した乳児への薬の影響を考慮する必要があります。
また、それだけではなく妊産婦さんは他の患者さんより副作用などのリスクが高くなることもあるので、より慎重に投与しなくてはいけない場合もあります。
動物実験や臨床使用経験、疫学調査などで得られたデータを根拠として、特に注意が必要な場合や適正使用に関する情報がある場合には、必要な情報が記載されます。
トランサミンの場合、特に問題ないのでこの項目は掲載されていません。
小児等への投与
臨床試験は小児等を除外してデザインされることが多いので、小児等の臨床試験のデータが少ないことが多いです。
成人に対して臨床効果や副作用の忍容性があったとしても、小児等で同じ結果になるとは言えないので、データなどが蓄積されるまでは投与しない、もしくか慎重に投与されることになります。
添付文書では小児等へのデータが不十分な場合、「未熟児、新生児、乳児または小児に対する安全性は確立していない。」と記載されます。
トランサミンの場合はある程度データが蓄積されているので、年齢ごとの投与量も設定されていますし、小児等への投与の項目も記載されていません。
薬物動態

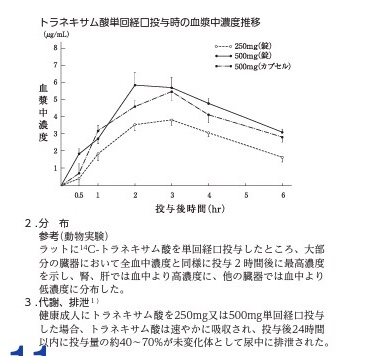
高齢者のところでも少し触れましたが、薬は口から飲み込むと小腸などから吸収されたのち血液に運ばれて全身の組織に分布します。その後、肝臓で代謝されたり、腎臓から排泄されたりします。
投与された薬の濃度とこの過程の関係を薬物動態と言いますが、この薬物動態は薬の種類(たとえば同じ系統の胃薬であったとしても)によって全く異なります。薬の薬物動態は人間でいう性格みたいなものなのかなと思います。
薬剤師はこの薬物動態のパラメータを見ることで、「どれだけの時間、薬が体内に残存するか」、「どれだけの割合が腎臓から排泄されるか」、「どの程度の時間で効果が発現するか」などを予想することができます。
トランサミンの場合
半減期(t1/2)が3.1~3.3時間となっていますが、これは血液中にあるトランサミンの濃度が半分になる時間が3.1~3.3時間かかるという意味です。半減期のおよそ5倍の時間で薬は体内からほとんど消失すると考えられていますので、15時間程度するとトランサミンは体内には残っていないと考えられます。
一回の投与量を増やすこと(250mg→500mg)で最高血中濃度(Cmax)も増加することから、しっかり効いてほしいときは多めの投与量が選ばれることもあります。
最高血中濃度到達時間(Tmax)が2~3時間であり、各臓器も同じくらいの時間で最高濃度になることから、効果が最大限発揮される時間が2~3時間だろうという予測もできます。
投与後24時間(すなわち体内からトランサミンが完全になくなる時間)以内に投与量の40~70%が未変化体(代謝物ではないということ)として尿中に排泄されたと記されていますが、これは投与されたトランサミンの40~70%は代謝されずにそのまま腎臓から排泄されることを示しています。
すなわちトランサミンの無毒化には腎臓が40〜70%寄与していることになります。
またこのデータからトランサミンの無毒化には腎臓以外にも30~60%、別の臓器が関与していると予想できます。おそらく肝臓による代謝がメインであると予想されますが、それ以外の排泄経路も考えられます。
この腎臓からの排泄、注意したいことがあります。
多くの添付文書には薬の尿への排泄の割合が記載されていますが、その割合が未変化体だけなのか代謝物も含まれたものなのか確認しなくてはいけません。
一部の添付文書では未変化体と代謝物を区別せずに尿中の総薬物濃度の割合が記載されていることもあります。その場合、尿中排泄の割合がたとえば90%だったとしても薬の無毒化に腎臓が90%寄与しているとは言えません。
あくまでも尿中の未変化体薬物濃度の割合が重要。
つまり未変化体の90%が腎臓から排泄されることが分かった場合のみ、薬の無毒化に腎臓が90%寄与していると言えます。
少し脱線してしまいましたが、薬物体内動態は薬の特徴、性格を理解するための重要な要素となります。
患者さんから「すぐに効きますか?」とか「どれくらいの時間効いてますか?」など質問されたときはこういった薬物動態のデータを参考に薬剤師は最善の回答をしています。
臨床成績

ここでは臨床試験の結果について、疾患別に症例数や有効率などが記載されています。
有効率に関してはプラセボのデータが表記されていない薬もあるので、薬の有効性を添付文書で評価する場合は注意が必要です。
トランサミンの場合、皮膚疾患の掻痒感、腫脹、紅斑などの症状や耳鼻科疾患の諸症状に対してプラセボよりも高い有効性が示されています。
逆に肝斑への有効性は添付文書では保障されていないので、肝斑の治療目的でトランサミンを投与する場合は保険適応外となります。
薬効薬理


薬の効能・効果を裏付ける薬理作用や作用機序が記載されています。データの根拠がin vitro試験(試験管内の実験)や動物実験の結果が用いられていることもあります。
トランサミンの場合も動物実験やin vitro試験などでその薬効薬理が示されています。
添付文書には書いていないこと
ここまで添付文書の記載内容について解説してきましたが、とても重要な注意点があります。
それは「添付文書情報には限界がある」ということです。
添付文書は確かに薬の重要な情報源ですが、これが全てということはなく、あくまで「情報ツールの一つ」であることを忘れてはいけません。
ちょっと昔話になりますが、私が総合病院のICUで働いていた頃。
しばしばICUの医師に「この抗生剤の投与量どうすればいい?」と質問されることがありました。
添付文書には「肺炎には○○mgを一日△回投与する」などと書かれているので、添付文書の情報だけから判断すれば、その投与量を伝えればいいことになります。
ただそれだけであれば、医師が添付文書を確認すればすぐに解決する話のはずですよね。
なぜ医師は薬剤師にそのような質問をしたのでしょうか?添付文書を確認することが面倒くさかったのでしょうか?
いえ、決してそんなことはありません。
医師は薬剤師にそれ以上のことを期待して質問しているのです。
医師に質問されたとき考えなければいけないことがたくさんあります。
日本と海外の投与量の違い
薬の投与量は日本と海外で違っていることもあるので、日本の投与量が海外でも一般的な投与量か確認する必要があります。
その際、添付文書以外に日本の感染症のガイドラインと海外の感染症のガイドラインを参考にします。
日本と海外の投与量に乖離がない場合は問題ありませんが、もし違う場合は日本の投与量で問題ないか医師と相談して決定します。
患者さんの状態
患者さんの感染症が一刻を争うような重症の場合、抗生剤は副作用のリスクも考慮しつつ最大限の投与量で投与されるべきだと思います。
添付文書に書かれている最大投与量を投与すればいいと思われるかもしれませんが、重症感染症の場合、抗生剤を体の外に出すための機能が低下していることもしばしばあります。
そのような状態で添付文書どおりの投与量で投与してしまうと副作用が発現して、患者さんが治療に耐えられなくなってしまいます。
ですので、薬剤師は患者さんの重症度と薬の排泄能の両面を評価して、総合的な最大投与量を医師に提案します。
薬剤の特性
最大限の投与量を提案しようと考えた時、その薬剤の特性を評価しないといけません。
抗生剤の投与量を決めるためには、いろいろと評価しなければなりません。以下にその例を簡単に書きました。
抗生剤の投与量を決めるときに考えること 「感染巣はどこ?=抗生剤の感染巣へどれだけ移行するか評価」 「患者さんの体格は?=一回の投与量を評価」 「腎機能、肝機能はどれくらいか?=抗生剤の排泄能の評価」 「血液透析や人工心肺などの体外循環はするか?=体外循環による薬の除去の可能性を評価」
上記のことを評価するためには、薬の特徴をしっかり把握していなければいけません。たとえば、
薬は水に溶けやすいか、油に溶けやすいか?
薬の大きさ(分子量)は大きいか?、小さいか?
血液中のたんぱく質に結合しやすいか?
このようなことを添付文書や別の情報ツールを使って確認し、薬が体の中でどのようになるか予想します。
そのうえで、いくつかあるガイドラインや参考書の内容を確認して患者さんにとって最も適切と考えられる投与量を医師に回答します。
というようにICUで働いていたころの私は医師とコミュニケーションを取りながら、様々な情報ツールを活用して患者さんにとっての適切な薬剤投与を心がけていました。
ここまでながながと書いてきましたが、大切なことは添付文書はとても重要な情報ツールであると同時に、情報ツールの一つでしかないということです。
薬剤師はその知識と添付文書情報を総合的に利用して、個々の患者さんのニーズに合った情報提供をすることが求められていると思います。
まとめ
薬剤師はもちろんですが、インターネットを使えば一般の方でも簡単にアクセスすることができる添付文書情報。
添付文書には重要な情報が記載されていますが、間違った読み方をすると不要な心配をしてしまう可能性もありますし、過度な効果を期待してしまいます。
添付文書に書かれている情報の意味を知っておくことや、その情報の限界を知っておくことはとても重要です。
添付文書はあくまでも情報ツールの一つであることを忘れないようにしましょう。
特に一般の方は添付文書を鵜呑みにするのではなく、身近な情報ツールである近隣の薬局で働いている薬剤師にぜひ相談してみてください。きっと皆さんの相談に乗ってくれるはずです。