この記事は美白成分として知られているトラネキサム酸が、本当に効果があるのか論文を紹介しながら解説していく第二弾となります。
美白肌全般について詳しく知りたい方は、まずこちらの記事をご覧ください。
肝斑などのしみで悩んでいる方にとっては、美白効果があると謳われる医薬品や化粧品があれば効果を期待して購入して試したくなるものです。ただ実際に美白効果が明確なものは多くありません。
実際、トラネキサム酸は肝斑改善薬とした厚生労働省から認可されており、OTC医薬品として「トランシーノⅡ」が販売されていますが、このトラネキサム酸の肝斑改善効果も医学的コンセンサスがあるわけではありません。
ただコンセンサスがないからと言っても効果がないというわけでもないので、我々は知り得る情報からより信頼できるものを選んで活用していかなければなりません。ここでもヘルスリテラシーが問題になるわけですが、ヘルスリテラシーに関してはこちらの記事を参考にしてください。
以前、肝斑に対するトラネキサム酸の効果について考えるために、こちらの記事でトラネキサム酸の肝斑改善効果について2016年までのデータをまとめた論文を紹介しました。
この論文から、3ヶ月以上トラネキサム酸を飲み続ければ、肝斑への効果が期待できそうという内容でした。ただ、それぞれのデータの条件にはバラつきがあり課題も多い論文だとも思いました。
そこで今回はさらに多くのデータを解析している論文を紹介したいと思います。
Tranexamic Acid for Adults with Melasma: A Systematic Review and Meta-Analysis
Lei Zhang et al. Biomed Res Int. 2018
要点
システマティックレビュー 2018年4月までの期間 21件の研究 治療前と治療後の肝斑面積・重症度指数(MASI)とメラニン指数(MI)の比較 トラネキサム酸の治療によりMASI、MIともに低下 副作用は軽度 トラネキサム酸は肝斑治療薬としての有効性と安全性が示唆れています。
個人的意見
以前紹介した論文より多くの研究かつ直近のデータまで解析しているので、肝斑治療薬としてのトラネキサム酸の現時点における評価を理解するうえでは適当な論文だと思います。
さまざまな肝斑の治療方法や治療効果の指標が適応されていることや、質の低い研究も多いため治療効果の評価は難しいです。
少なくとも安全性の高い薬剤であることは疑いようがありませんし、治療効果もネガティブなものではなさそうなので、肝斑治療の選択肢の一つとして考慮してもいいのではないでしょうか。
以下にこの論文について要点をまとめてみましたので、参考にしてみてください。
イントロダクション
肝斑は不規則に色素沈着した斑が特徴的な後天性の色素障害であり、一般的には紫外線の強い地域に住んでいる肌の色の濃い女性に発症するとされています。
肝斑の発症には紫外線、妊娠、ホルモン活動、甲状腺異常、薬剤、遺伝的素因など多くの要因が関係していると言われています。
これらの要因によりメラノサイト(メラニン細胞)で増加したメラノソームがケラチノサイト(角化細胞)に移行することで色素沈着が増えます。
肝斑の治療は一般的にメラニンを合成する経路を阻害し、メラノソームのメラノサイトからケラチノサイトへの移行を減少させることを目的としています。
肝斑の治療は、紫外線からの保護、色素沈着抑制剤、ケミカルピーリング、レーザー、皮膚剥離など様々な治療が行われています。
ハイドロキノンなどのいくつかの外用剤はさまざまな合併症のデメリットがありますし、 ケミカルピーリングやレーザーなどの物理的な治療法は副作用や金銭的負担などのデメリットがあります。
トラネキサム酸はプラスミノーゲンからプラスミンへの変換を阻害することで止血効果を発揮するため、過剰出血を防ぐための止血剤として使用されます。
トラネキサム酸は現在では美白剤として外用剤、皮内注射剤、経口剤として使用されていて、肝斑の治療薬として期待されていますが、米国食品医薬品局(Food and Drug Administration of the United States)では肝斑の治療薬として承認されておらず、治療法についてはまだ議論のあるところです。
このシステマティックレビューの研究では肝斑に対するトラネキサム酸の治療効果を評価しています。
対象と方法
データベース検索
2018年4月26日に検索
PubMed、EMBASE、コクラン図書館のデータベースから検索
検索キーワード
・トラネキサム酸
「tranexamic acid」、「antifibrinolytic agents」、「trans-4-(Aminomethyl)cyclohexanecarboxylic acid」
・肝斑
「chloasmas」、「melasma」
2 名のレビュアー(LZ と XWW)が独立してすべての研究を評価し、評価が最終決定に至らなかった場合には、3 人目のレビュアー(WQT)を招聘して決定されています。
研究の選択基準
(1)トラネキサム酸を用いた肝斑の治療法を記載したオリジナル研究(ランダム化比較試験(RCT)、コホート研究、症例対照研究)
(2)トラネキサム酸による単独または他の治療法との併用による治療法
(3)肝斑面積・重症度指数(MASI)、メラニン指数(MI)、紅斑指数(EI)などの肝斑のアウトカム指標のいずれかを報告
除外基準
(1)関連性のないトピック、重複、レビュー、コメント
(2)適切なデータまたは完全なデータがない
(3)肝斑特有のアウトカム指標を報告していない
抽出データ
研究の特徴(筆頭著者、発表年、国・地域、参加者のサンプルサイズ)、薬物療法介入、投与方法、追跡期間、アウトカム(MASI、MI、EI)、有害反応
研究の質の評価
RCT は Cochrane risk-of-bias ツールを用いて評価。 症例対照研究とコホート研究についてはNewcastle-Ottawa Scale の risk-of-bias 基準を採用
トラネキサム酸による肝斑治療の主な指標
治療前後のMASI、MI、EIスコアの差と、日常的な治療とトラネキサム酸をアジュバントとして使用した場合のMASIスコアの差について解析
サブグループ解析
トラネキサム酸の投与経路(経口、外用、注射)
結果
検索結果
139 件の英語論文を検索し、解析に含める基準を満たしていない研究を除外した結果、21の研究が解析の対象となっています。
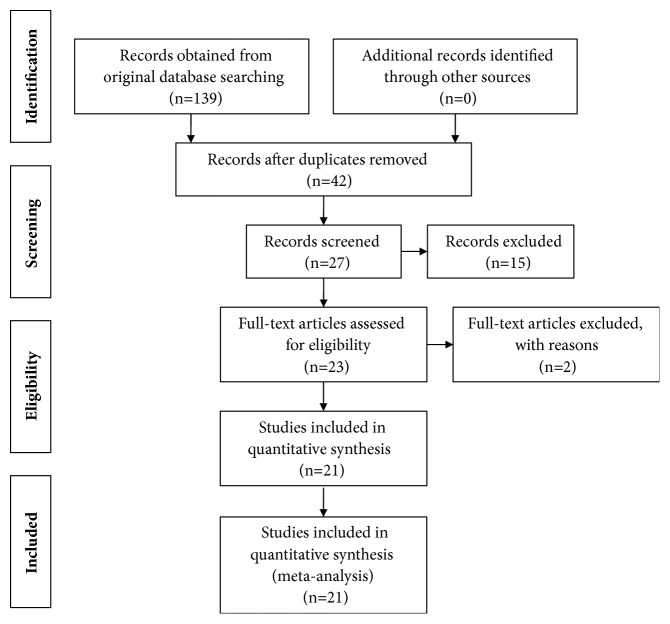
研究の特徴
2006年から2018年までに発表された研究
RCT16件、コホート研究3件、ケースコントロール研究2件
韓国で6試験、イランで5試験、インドで4試験、中国で2試験、ブラジルで1試験、ネパールで1試験、シンガポールで1試験、米国で1試験
合計1563人の肝斑患者
すべて成人、80%~100%が女性
肝斑の重症度は、MASI、MI、EIで評価(12試験はオリジナルのMASIスコア、6試験は修正MASIスコア、3試験はMIスコア、3試験はEIスコア)
経口投与の患者
1 日 500mg または 750mg の投与量
注射(局所)の患者
2~8mg、0.2mg/cm2の投与量を患部に投与
外用の患者
形態:リポソーム、乳液・クリーム、ローション、カタプラズムなど
投与量:0.5%~5%の外用剤を患部に塗布
平均治療期間
約8~12週間
The characteristics of included studies.
| Study (first author, year) | Country | Completed/Participants | Age, y | Delivery mode | TA treatment∗ | Primary outcome§ | Side effects (patients) |
|---|---|---|---|---|---|---|---|
| Shin 2013[11] | Korea | 44/48 | 48†(28-56) | Oral | 750mg (Qd, 8W) + QSNY (2 rounds, 4W intervals) | mMASI | Heartburn (1); Nausea (1) |
| Budamakuntla 2013[12] | India | 52/60 | – (18-50) | Injection | MI: 8mg (Qm, 8W) MN: 2-4mg (Qm, 8W) | mMASI | Itching (4); Burning (3); Erythema (8) |
| Lajevardi 2016[13] | Iran | 88/100 | – (18-65) | Oral | 250mg (Tid, 12W) + Topical 4% HQ (Qn, 12W) | MASI | Therapy-related complications (3); Abdominal pain (2) |
| Banihashemi 2015[14] | Iran | 23/30 | – (25-47) | Topical | 5% TA (Qn, 12W) | MASI | None |
| Na 2012[15] | Korea | 22/25 | – (20-55) | Oral+ Topical | Oral TA 250mg (Tid, 8W) + Topical 2% TA (Bid, 8W) | MI; EI | None |
| Kim 2016[16] | Korea | 23/23 | – (34-60) | Topical | Emulsion 2% TA (Bid, 12W) + Fabric mask 2% TA (Tiw, 12W) | mMASI | None |
| Lee 2006[17] | Korea | 85/100 | 38‡(29-46) | Injection | 0.2mg/cm2 (Qw, 12W) | MASI | None |
| Padhi 2015[18] | India | 40/40 | 36‡(24-55) | Oral | 250mg (Bid, 8W) + Topical 4% HQ (Qd, 8W) | MSAI | Erythema (2); Burning (2); Hypopigmentation/Depigmentation (2); Oligomenorrhoea (1) |
| Karn 2012[19] | Nepal | 260/260 | 30‡(17-55) | Oral | 250mg (Bid, 12W) + Topical HQ | MASI | Oligomenorrhoea (19); Belching (12); Abdominal cramps (9); Palpitation (1); Urticarial rash with angioedema (1) |
| Tan 2016[20] | Singapore | 25/25 | 47‡(32-63) | Oral | 250mg (Bid, 12W) | MASI | None |
| Rosario 2017[21] | USA | 39/44 | 44‡ (-) | Oral | 250mg (Bid, 12W) | mMASI | Moderate myalgias (1) |
| Cho 2013[22] | Korea | 51/51 | 41‡ (-) | Oral | 500mg (Qd, 8W) + IPL + QSNY (3-4 rounds, 1-2W intervals) | mMASI | Transient headache (4) |
| Atefi 2017[23] | Iran | 60/60 | 39‡ (-) | Topical | 5% TA (Bid, 12W) | MASI | None |
| Sharma 2016[24] | India | 80/100 | 37‡(18-55) | Oral Injection | Oral TA 250mg (Bid, 12W) TA Injection 4mg (3 rounds, 4W intervals) | MASI | Oral: Hypomenorrhea (6); Epigastric discomfort (2) Injection: Injection site pain and transient oedema (13) |
| Ebrahimi 2014[25] | Iran | 39/50 | 40‡(29-51) | Topical | 3% TA (Bid, 12W) | MASI | Erythema, skin irritation, xerosis, and scaling (Total: 9) |
| Chung 2015[26] | Korea | 13/15 | 41‡ (-) | Topical | 2% TA (12W) + IPL (4 rounds, 4W intervals) | mMASI | None |
| Thillaikkarasi 2017[27] | India | 48/60 | 40‡ (-) | Oral Injection | Oral TA 250mg (Bid, 12W) TA Injection 4mg (3 rounds, 4W intervals) | MASI | Hypothyroidism (5); Irregular menstrual cycle (7 females); Depression and anxiety (38) |
| Saki 2017[28] | Iran | 31/37 | 36‡(25-49) | Injection | 3 rounds, 4W intervals | MI; EI | Unknown |
| Steiner 2009[29] | Brazil | 17/18 | 41‡(23-52) | Topical Injection | Topical 3% TA (Bid, 12W) TA Injection 0.2mg/cm2(Qw, 12W) | MASI | Side effects were minimal. |
| Lu 2017[30] | China | 81/84 | 43†(23-58) | Topical | 2.5% TA (7h/d, 8W) | MASI | None |
| Xu 2017[31] | China | 28/30 | 39‡(20-50) | Topical | 0.5% TA (Qw, 12W) | MI; EI | None |
†Median age. ‡Mean age.
研究の質の評価
研究の質はthe Cochrane risk-of-bias tool、the Newcastle-Ottawa Scaleで評価されていますが、質が高いと評価された研究は少数。
Risk-of-bias assessment of included randomized controlled trials∗.
| Study (first author, year) | Adequate sequence generation | Allocation concealment | Blinding of participants | Blinding of assessment | Incomplete outcomes data addressed | Selective reporting | Free of other bias |
|---|---|---|---|---|---|---|---|
| Atefi 2017 | Low | Low | Low | Unclear | Low | Unclear | Unclear |
| Banihashemi 2015 | Unclear | Unclear | High | Unclear | High | Unclear | Unclear |
| Budamakuntla 2013 | Unclear | Unclear | Low | High | High | Unclear | Unclear |
| Chung 2015 | Unclear | Unclear | High | High | Low | Unclear | Unclear |
| Ebrahimi 2014 | Unclear | Unclear | Low | Unclear | Low | Unclear | Unclear |
| Karn 2012 | Low | Unclear | High | High | Low | Unclear | Unclear |
| Lajevardi 2016 | Low | Low | Low | Low | High | Unclear | Unclear |
| Lu 2017 | Low | Unclear | Low | Low | Low | Unclear | Unclear |
| Padhi 2015 | Unclear | High | High | Unclear | Unclear | Unclear | Unclear |
| Rosario 2017 | Low | Low | Low | Low | Unclear | Unclear | Unclear |
| Saki 2017 | Unclear | Unclear | High | Unclear | High | Unclear | Unclear |
| Sharma 2016 | High | Unclear | High | Unclear | Low | Unclear | Unclear |
| Shin 2013 | Unclear | Unclear | High | Low | Low | Unclear | Unclear |
| Steiner 2009 | Unclear | Unclear | High | Low | Unclear | Unclear | Unclear |
| Thillaikkarasi 2017 | Low | High | High | Unclear | Unclear | Unclear | Unclear |
| Xu 2017 | Unclear | High | High | Low | Low | Unclear | Unclear |
∗Risk of bias was assessed with use of the Cochrane risk-of-bias tool.
Assessment of the quality of cohort studies∗.
| Study (first author, year) | Selection | Comparability | Outcome | Score | |||||
|---|---|---|---|---|---|---|---|---|---|
| Representativeness of exposed cohort | Selection of nonexposed cohort | Ascertainment of exposure | Demonstration that outcomes† | Assessment | Enough follow-up | Adequacy of follow-up of cohorts | |||
| Kim 2016 | ☆ | – | ☆ | ☆ | ☆☆ | – | ☆ | ☆ | 7 |
| Lee 2006 | ☆ | – | ☆ | ☆ | ☆☆ | – | ☆ | – | 6 |
| Na 2012 | ☆ | – | ☆ | ☆ | ☆☆ | – | ☆ | – | 6 |
∗The assessment was based on the Newcastle-Ottawa Scale. The full mark of total score is defined as 9; a score of >7 indicates a low risk of bias.
†A demonstration about the outcomes of interest was not present initially.
ssessment of the quality of case-control studies∗.
| Study (first author, year) | Selection | Comparability† | Exposure | Score | |||||
|---|---|---|---|---|---|---|---|---|---|
| Definition adequate? | Representativeness of cases | Selection of controls | Definition of controls | Ascertainment of exposure | Same method of ascertainment | Nonresponse rate | |||
| Cho 2013 | ☆ | ☆ | ☆ | ☆ | ☆☆ | ☆ | ☆ | – | 8 |
| Tan 2016 | ☆ | ☆ | – | – | ☆☆ | ☆ | – | ☆ | 6 |
∗ The assessment was based on the Newcastle-Ottawa Scale. The full mark of total score is defined as 9; a score of >7 indicates a low risk of bias.
† Comparability of cases and controls on the bias of design or analysis.
介入の効果
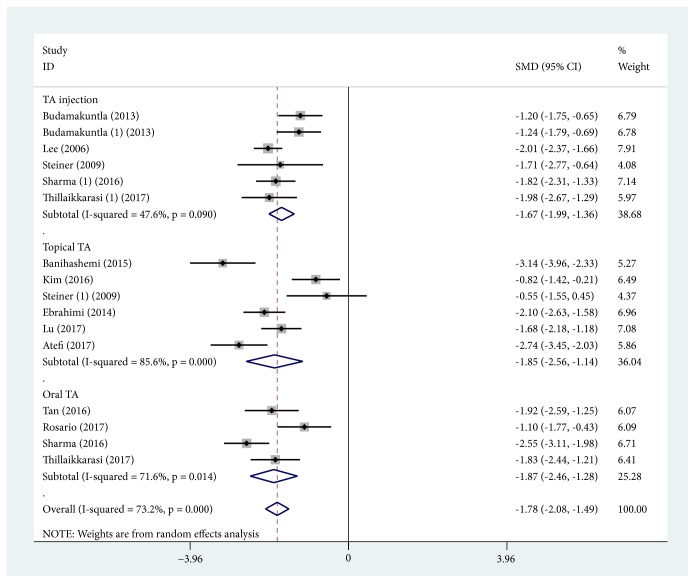
MASI スコアの変化の比較(トラネキサム酸単独)
トラネキサム酸治療前後のMASIスコアの変化をアウトカムとして定義した12 試験は、MASI スコアの減少を示していました。
注射投与(5件)の場合:(SMD, 1.673; 95% CI, -1.990 ~ -1.356; P < 0.0001; I2 = 47.6%)
局所投与(6件)の場合:(SMD,1.850; 95% CI, -2.556~-1.144; P < 0.0001; I2 = 85.6%)
経口投与(4件)の場合:(SMD,1.866; 95% CI, -2.456~-1.276; P < 0.0001; I2 = 71.6%)
全体:(SMD,1.783; 95% CI, -2.076~-1.490; P < 0.0001; I2 = 73.2%)
広い信頼区間に示されるようにトラネキサム酸治療単独のサブグループ内では、高い統計学的に有意な不均一性がありましたが、3つのサブグループ間では不均一性は認められませんでした(I2 = 0%)。
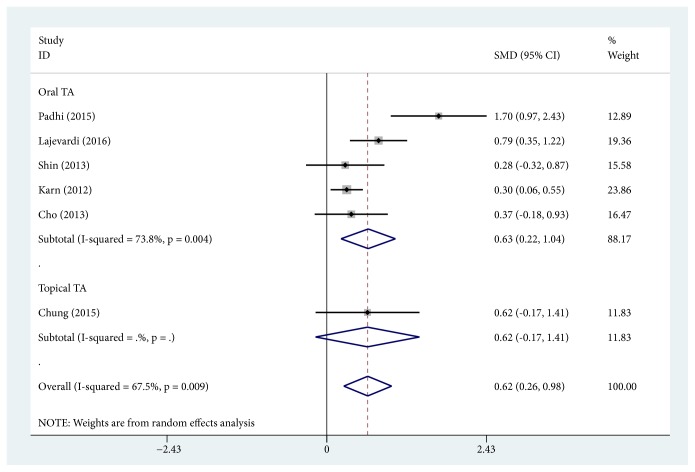
MASI スコアの変化の比較(トラネキサム酸併用)
6つの研究では、肝斑治療に対するトラネキサム酸のアジュバント治療併用の有無によるMASIスコアの変化について比較されていて、トラネキサム酸の併用によってMASIの減少が示されています。
経口トラネキサム酸アジュバント治療(5件):(SMD、0.629;95%CI、0.216~1.042;P=0.003, I2=73.8%)
局所トラネキサム酸アジュバント治療もMASI(SMD, 0.618; 95% CI, -0.171~1.406; P = 0.125)
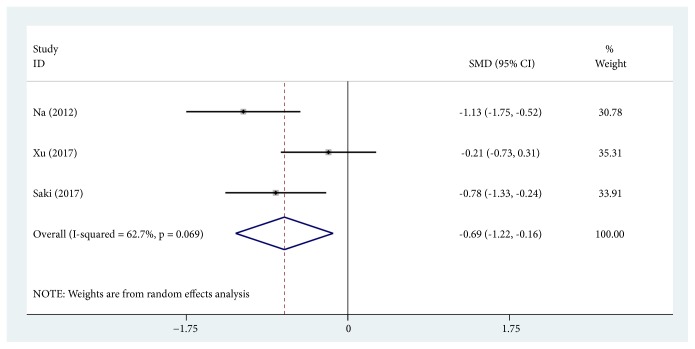
MIスコアの変化の比較
治療前後のMIスコアが比較されトラネキサム酸の治療により減少することが示されました(3件):(SMD, -0.689; 95% CI, -1.217~-0.160; P=0.011, I2=62.7%)。
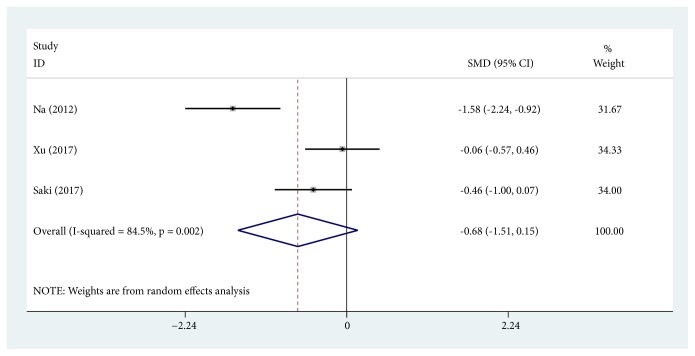
EIスコア変化の比較
治療前後のEIスコアが比較されましたがトラネキサム酸の治療による有意な差はありませんでした(3件) :(SMD, -0.677; 95% CI, -1.507~0.153; P = 0.110; I2 = 84.5%)。
副作用
21 件の試験のうち、10 件の試験が副作用に関連していました。
経口剤
主な副作用は胸やけ、吐き気、腹痛、胃部不快感などの消化器反応でした。
一部の患者では乏尿症、色素沈着、血管浮腫を伴う蕁麻疹、中等度の筋肉痛、一過性の頭痛、不安感、抑うつ感を示しされました。
外用剤
主な副作用は皮膚刺激性の脱毛、鱗屑など。
注射剤
一過性の浮腫や注射部位や疼痛。
経口剤・外用剤・注射剤共通
わずかな症例数で紅斑
出版バイアス
MIとEIの指標はいずれも3本の論文しかなかったため、特別な有意性のないファネルマップの基準を満たしていませんでした。
Egger法で評価されたMASIスコアにおける出版バイアスに有意性は認められませんでした(P=0.760)。
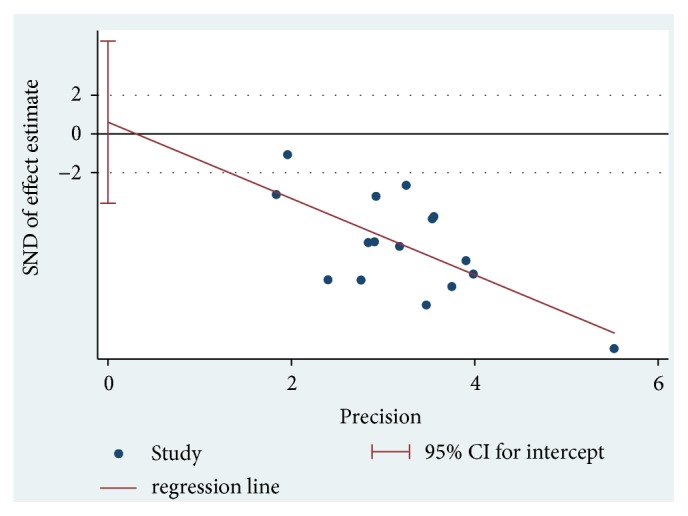
Egger’s test of publication bias.
| Outcome | Std. Eff. | Coef. | Std. Err. | t | P > |t| | [95% Conf. Interval] | |
|---|---|---|---|---|---|---|---|
| MASI score | Slope | -1.974574 | 0.5844401 | -3.38 | 0.005 | -3.228074 | -0.7210746 |
| Bias | 0.6088802 | 1.955849 | 0.31 | 0.760 | -3.585999 | 4.803759 |
考察
トラネキサム酸単独およびアジュバント治療の試験で、無作為化された性別に関係なく、成人1563人の患者データのメタアナリシスでは、MASIおよびMIスコアの非常に有意な減少が見られましたが、EIスコアでは見られませんでした。
サブグループ解析では、経口、外用、注射のトラネキサム酸単独とアジュバント経口トラネキサム酸の有益性が示唆されました。その中でMASIスコアは非常に有意に減少しました。 しかし、アジュバント局所トラネキサム酸の研究は一つしかなかったため、ルーチン治療と比較してMASIスコアに有意差を示しませんでした。
トラネキサム酸は、プラスミノーゲン活性化をブロックし、線溶を停止する効果があるので、出血を抑えるためにしばしば使われてきました。 トラネキサム酸の適応症には肝斑の治療は含まれていませんでしたが、肝斑に対する潜在的な有効性は1980年代から一貫して報告されています。
一般に、肝斑は後天的な対称性色素沈着の疾患であることが知られています。 紫外線照射はケラチノサイトによるプラスミノーゲン活性化因子の合成を誘導し、その結果、プラスミノーゲンからプラスミンへの変換が増加します。トラネキサム酸はプラスミノーゲン/プラスミン系の阻害を通じて、メラノサイトとケラチノサイトの相互作用を遮断することで、紫外線誘発性の表皮メラノサイトチロシナーゼ活性を抑制することができます。 しかし、肝斑に対するトラネキサム酸治療は、依然として物議を醸しています。
ここ数年に発表された最近のメタアナリシスでは、肝斑に対するトラネキサム酸の有効性と安全性が評価されています。 以前のシステマティックレビューと比較して、このレビューで12研究が新たに含まれました。 そして、これらの論文のほとんどは2017年または2018年に発表されています。
重要なことはトラネキサム酸の異なる投与量でのサブグループ分析と、Eggerテストで行った出版バイアス分析を行ったことです。 さらに、MASIスコア以外にも、このシステマティックレビューでは、肝斑のためのより多くの指標(MIとEI)が検出されました。
肝斑の重症度と治療中の変化を正確に定量化するために考案された指標であるMASIは、Kimbrough-Greenらによって最初に使用されました。肝斑の専門家は、ほぼ20年間、主要なアウトカム指標としてMASIスコアを使用しており、コンテンツの妥当性もあることを示唆しています。個々の要素、特に均質性と顎の評価には問題はありますが、MASIスコアシステムは今でも肝斑のアウトカム指標として最も一般的に使用されています。
MIスコアは主にメラニン含有量の影響を受けるパラメータと考えられています。 顔全体を評価するMASIスコアと比較して、MIとEIスコアは、反射率計を用いて肝斑領域(病変部)で測定されます。 また、顔全体の面積と重症度のスコアで構成されているMASI スコアは、顔全体の分割評価には適さないとの理由で、この研究に含まれるいくつかの試験はMASIスコアを使用していません。
この研究では、トラネキサム酸が肝斑患者にとって安全で効率的な薬剤であることを証明しています。単剤治療とアジュバント治療の両方で、副作用を最小限に抑えながらMASIとMIのスコアを有意に減少させることが示されました。 しかし、3つの臨床試験を合わせた結果では、トラネキサム酸治療の有無にかかわらずEIスコアに有意な差は認められませんでした。試験デザインの違いから、肝斑患者においてトラネキサム酸がEIを減少させることは確認できませんでした。
プラスミンは、細胞外マトリックスに結合した血管内皮増殖因子を自由に拡散可能な形態に変換するため、血管新生に重要な役割を果たしていることが知られていますが、トラネキサム酸は血管新生を阻害し、基礎線維芽細胞増殖因子によって誘導される新生血管化も抑制します。 EIの減少に対するトラネキサム酸の効果の強力なエビデンスを提供するためには、より質の高い試験が必要です。
肝斑の治療のためのトラネキサム酸の1日の全身投与量は500mgから700mgの範囲と報告されていて、月経過多や周術期の血友病患者に有効とされている1日投与量よりはるかに少ない。 それにもかかわらず、経口トラネキサム酸の使用による重篤な副作用の可能性を考慮して、肝斑に対する注射または外用トラネキサム酸の評価に関心が寄せられています。
局所的なトラネキサム酸は、単独または皮内注射、マイクロニードル、分画 CO2 レーザーなどと組み合わせて適用され、バイオアベイラビリティを向上させています。しかし、サンプルサイズが小さく、質の悪い研究デザインのため、現在利用可能なデータには制限があります。
水溶性トラネキサム酸の局所投与が皮膚の脂質可溶性表面に経皮吸収されるかどうかについては議論があります。 肝斑患者の選択肢としての外用薬の理解における知識のギャップを埋めることに加えて、トラネキサム酸の異なる投与方法間での臨床効果と副作用の比較に関するさらなる研究が実施されるべきである。
このメタアナリシスとシステムレビューには、以下のようないくつかの制限があります。第一に、このメタアナリシスに含まれる試験では、フォローアップ期間や投与量が多様であり、MASIスコアの使用形態が異なっていました。
第二に、研究の質が低く、MASIスコアの評価がその過程での主観的な要因に影響されている可能性がありました。さらに、今回のシステマティックレビューではMASI、MI、EIの不均一性が大きくなりましたが、これはサンプルサイズと研究の質が原因である可能性があります。
しかし、連続変数では高い異質性がより一般的であることに注意が必要です。 異なるトラネキサム酸の投与形態でサブグループ分析を行い、異なる程度のサブグループ内I2の低下が観察されました。 しかし、個人差の観点から不均一性を評価することは困難です。
上記の欠点にもかかわらず、このシステマティックレビューとメタアナリシスは、肝斑患者へのトラネキサム酸の適用について、現在利用可能な予備的なエビデンスを提供しています。
結論
メタアナリシスの結果から、トラネキサム酸は肝斑患者に対して有効で安全な治療法であると考えられる。 しかし、方法論的に質の高い研究が不足しているため、結論を出すには不十分な結果となっています。 肝斑に対する TA の有効性と安全性を確認するためには、より厳密に設計された、より大きなサンプル数の試験が必要です。
論文の結果を踏えて・・・トラネキサム酸の個人的評価
以前紹介した論文の時にも書いたことですが、各データにばらつきがあることからもわかるとおり、この論文の結果を鵜呑みにしてはいけないと思います。日光暴露の程度や肝斑の重症度は結果に影響を与えると思いますが、その点を評価できていない点は課題だと思います。
この論文では内服・注射・局所投与といずれのトラネキサム酸の投与方法でも、肝斑への治療効果が期待できることを示唆しています。安全性に関しても健康な方に使用する分には安心して使える薬剤であることがわかります。
それぞれの研究の質の問題などから、あくまでも効果がありそうだということしか言えませんが、肝斑で困っている方にとっては試してみてもいい薬剤だと思います。
腎臓の機能が低下している方は、トラネキサム酸が体内に蓄積してしまうので服用には注意が必要なので、服用を希望される場合は医師や薬剤師に相談してください。特に人工透析患者さん痙攣が起きた報告もありますので、飲まないようにして下さい。
トラネキサム酸には止血効果があるため、血栓症リスクを高める可能性が報告されていますが、一般的には血栓症リスクを増加させるという明確なエビデンスはありません。血栓性素因のある患者さんは飲めませんが、重篤な副作用は稀であり、安全性の高い薬剤になります。
月経困難症などでピルを服用している方もいると思いますが、ピルは血栓症のリスクを増加させるため、トラネキサム酸との併用注意が必要になります。ピルとトラネキサム酸の相互作用に明確なエビデンスがあるわけではありませんが、薬理作用から積極的に投与を推奨する医療機関は少ないです。
トラネキサム酸の副作用が気になる方は、副作用の少ない塗り薬などの局所投与を検討してもいいかもしれませんね。
注意していただきたいこととしてトラネキサム酸の投与はあくまでも肝斑に対してということです。
テレビにしろインターネットにしろ、しばしば「シミにはトラネキサム酸」みたいな誇大広告を目にします。トラネキサム酸配合の化粧品を高額で購入されている方もいるとは思いますが、肝斑以外のシミには効果は期待できません。せっかく美容にコストをかけるのであれば、より効果が期待できる保湿などのスキンケアやレーザー治療に重点を置くことをお勧めします。
以上、トラネキサム酸の肝斑に対する有効性について論文を紹介しながら考えてみました。トラネキサム酸を使用したいと思った方は、医師や薬剤師に相談して使ってみてください。